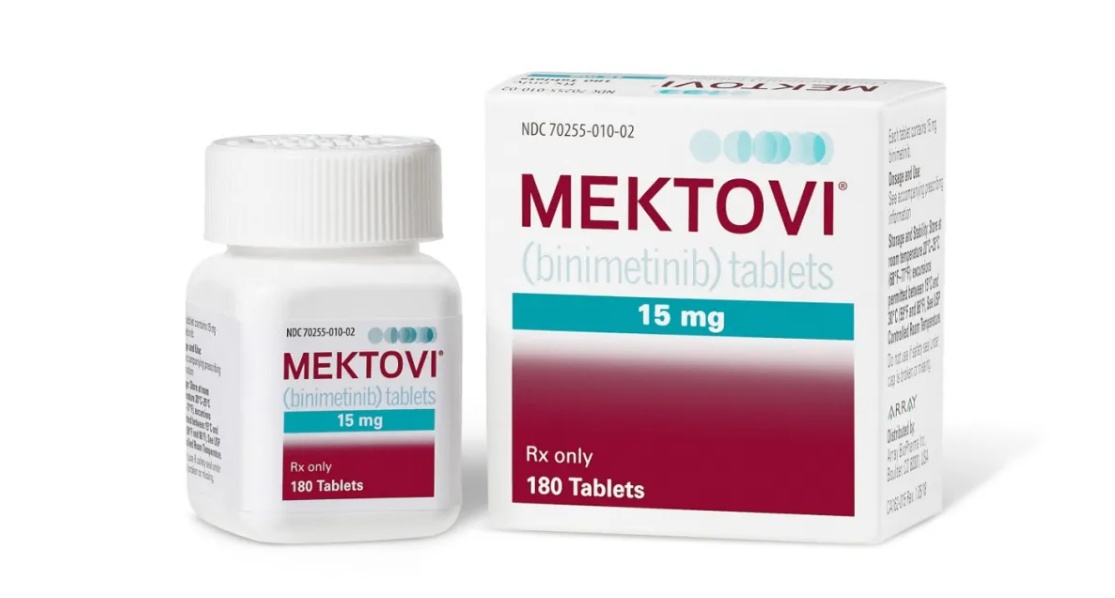
Mektovi贝美替尼Array BioPharma Binimetinib中文说明书
- 商品名:Array BioPharma
- 药品名:Mektovi Tablets
- 规 格:15毫克/片 180片/瓶
- 适应症:黑色素瘤
- 原 研:美国Array BioPharma制药
- 价 格: 咨询印度博生药房商城客服
剂量和给药





比美替尼(Binimetinib)曾经译为贝美替尼,是一种MEK的选择性抑制剂,MEK是促进肿瘤的MAPK途径中的中枢激酶,...
关注度:67入库时间:2026-01-22
贝美替尼也可以叫做比美替尼,临床上与Braftovi(康奈非尼)联合使用,适用于治疗BRAF V600E或V600K突变的...
关注度:67入库时间:2023-04-06
贝美替尼商品名也可以叫做比美替尼,与encorafenib(康奈非尼)联合用于治疗无法切除或转移的BRAF V600E或...
关注度:73入库时间:2023-04-06
贝美替尼是一种口服的MEK1和MEK2抑制剂,根据多项临床实验中显示,使用贝美替尼的疗效确切,可以使得...
关注度:118入库时间:2023-04-06
贝美替尼是一种有丝分裂原激活的细胞外信号调节激霉1(MEK1)和MEK2活性的可逆抑制剂,临床上治疗黑色...
关注度:204入库时间:2023-04-06
贝美替尼/比美替尼是一种激酶抑制剂,临床上可与恩考芬尼联合可用于治疗患有BRAF V600E或V600K突变的不可...
关注度:187入库时间:2023-04-06
贝美替尼(比美替尼)是一种MEK抑制剂,能有效抑制细胞中的细胞外信号相关激酶(ERK)磷酸化免疫测定...
关注度:172入库时间:2023-04-07
比美替尼(贝美替尼)商品名:Mektovi,与康奈非尼(Braftovi)联合使用治疗BRAF V600E或V600K突变的不可切除...
关注度:202入库时间:2023-04-07
Mektovi/贝美替尼是丝裂原活化细胞外信号调节激酶1(MEK1)和激酶2(MEK2)活性的可逆抑制药,与encorafenib联合用...
关注度:126入库时间:2023-04-07