FDA批准Voyxact(sibeprenlimab-szsi)用于降低成人原发性免疫球蛋白A肾病患者
来源:网络收集 收录时间:2026-01-31热度: ℃
【资讯导读】FDA批准: 是(首次批准日期:2025年11月25日) 商品名: Voyxact 通用名: sibeprenlimab-szsi 剂型: 注射剂 公司: 大冢制药株式会社 治疗适应症: 免疫球蛋白A肾病 Voyxact (sibeprenlimab-szsi)
FDA批准:是(首次批准日期:2025年11月25日)
商品名: Voyxact
通用名: sibeprenlimab-szsi
剂型:注射剂
公司: 大冢制药株式会社
治疗适应症: 免疫球蛋白A肾病
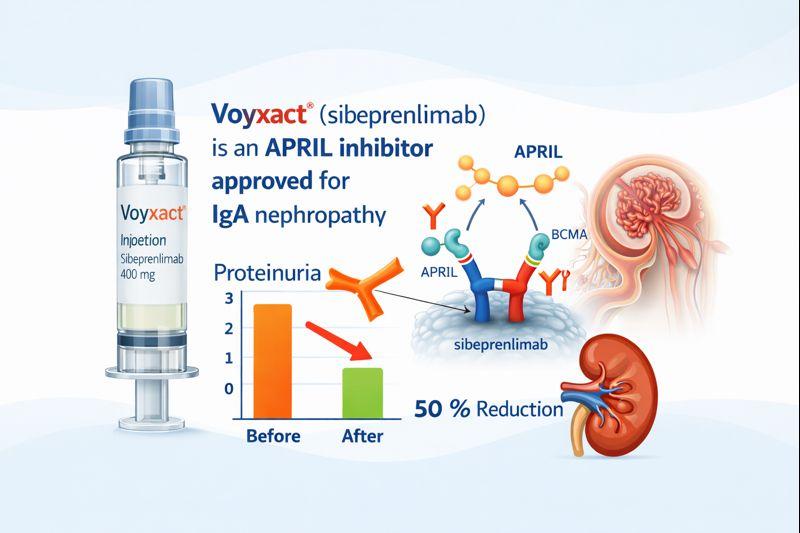
Voyxact(sibeprenlimab-szsi)是一种A增殖诱导配体(APRIL)阻滞剂,适用于降低有疾病进展风险的原发性免疫球蛋白A肾病成年患者的蛋白尿。
-
该适应症是基于蛋白尿减少而获得加速批准的。目前尚未确定 Voyxact 能否长期延缓 IgA 肾病患者的肾功能下降。该适应症的持续批准可能取决于在验证性临床试验中对临床获益的验证和描述。
-
免疫球蛋白A肾病(IgAN)是一种自身免疫性疾病,其特征是肾脏中缺乏半乳糖的IgA1(Gd-IgA1)复合物的积聚。它与肾功能进行性丧失以及进展为终末期肾病的高风险相关。
-
Voyxact 含有 sibeprenlimab-szsi,其作用机制是选择性地结合并抑制 APRIL 的活性。APRIL 是一种肿瘤坏死因子 (TNF) 家族的细胞因子,它能促进 B 细胞的存活和类别转换,从而产生 IgA,尤其是致病性 Gd-IgA1。Voyxact 通过降低 Gd-IgA1 的水平,可能有助于延缓肾脏损伤并阻止疾病进展至终末期肾病。
-
FDA 加速批准是基于 VISIONARY 3 期中期分析,其中 Voyxact 在治疗 9 个月(n=320)后,与安慰剂相比,蛋白尿减少了 51%(P<0.0001)(Voyxact 组 50%,安慰剂组 2%)。
-
Voyxact 每 4 周皮下注射一次,患者可自行给药。
-
与 Voyxact 相关的警告和注意事项包括免疫抑制和感染风险增加。
-
常见不良反应包括上呼吸道感染和注射部位红斑。
本站部分文章/图片收集于网络!如涉及版权请联系我们核实删除

